Sie sollen von Schmerzen befreien und die Lebensqualität wieder steigern. Treten bei Implantaten jedoch Produktmängel auf, hat das nicht nur für den Patienten unangenehme Folgen. Serienschäden können in die Milliarden gehen. Höchste Sorgfalt im Underwriting ist daher Pflicht.
Wachstumsmarkt Implantate
TOPICS
© decade3d - anatomy online / Shutterstock.com
- Topics Online - Deutsch
- Leben/Gesundheit
- Gesundheitsrisiken
- Implantate unter der Lupe
Gesundheitsrisiken
Implantate unter der Lupe
Sie sollen von Schmerzen befreien und die Lebensqualität wieder steigern. Treten bei Implantaten jedoch Produktmängel auf, hat das nicht nur für den Patienten unangenehme Folgen. Serienschäden können in die Milliarden gehen. Höchste Sorgfalt im Underwriting ist daher Pflicht.
23.08.2016
Über diesen Artikel
Wachstumsmarkt Implantate
Allein in Deutschland werden jährlich rund 400.000 künstliche Hüften und Knie implantiert. Weitere 100.000 Patienten erhalten einen Herzschrittmacher oder einen Defibrillator. Die Weiterentwicklung von Werkstoffen und Operationstechniken, der demografische Trend und zunehmende Zivilisationskrankheiten wie Adipositas (Fettleibigkeit) werden Eingriffe dieser Art weiter steigen lassen. Der Einsatz von Implantaten ist ein großer Fortschritt zur Verbesserung der Lebensqualität – vor allem im Alter. Doch auch Eingriffe aus rein ästhetischen Gründen boomen. Über 400.000 Brustimplantationen inklusive Implantatswechsel werden alljährlich in den USA durchgeführt. Nur 20 Prozent davon dienen zur Rekonstruktion der Brust aufgrund einer Erkrankung oder Schädigung.
Nicht alle Eingriffe verlaufen ohne Komplikationen und sichern langfristig eine beschwerdefreie Zukunft. Neben den unausweichlichen Risiken, die mit einem operativen Eingriff einhergehen, führen immer wieder Produktmängel zu Schmerzen, zusätzlichen belastenden Behandlungsmaßnahmen oder gar zum vorzeitigen Austausch des Implantats. In der Vergangenheit haben Schadenersatzansprüche oder Produktrückrufe bei vorzeitigem Versagen oft die 100-Millionen-Dollar-Marke überschritten. Prominente Produkthaftpflichtfälle führten auch zur intensiven Diskussion, ob die gegenwärtigen Zulassungs- und Zertifizierungsverfahren für Implantate noch angemessen sind, um Patienten ausreichend vor Produktrisiken zu schützen.
Implantate gehören zur höchsten Risikoklasse
Bevor ein Implantat vermarktet werden kann, bedarf es einer Zulassung bzw. Zertifizierung. Regulatorisch werden sie nicht als Arzneimittel, sondern als Medizinprodukte eingeordnet und unterliegen daher auch anderen Zulassungsvorschriften. So sind zum Beispiel klinische Prüfungen bei dieser Produktgruppe häufig nicht erforderlich. Üblicherweise werden Medizinprodukte in die Risikoklassen I, II oder III eingestuft, wobei die Klasse I Produkte mit geringem Risiko erfasst. Dazu gehören Verbandmittel, Gehhilfen oder Rollstühle. Produkte der Klasse II sind mit mittlerem Risiko eingestuft. Und in Risikoklasse III finden sich Produkte mit dem höchsten Risiko wie künstliche Hüft- oder Kniegelenke, Herzschrittmacher und Brustimplantate. Je höher die Risikoklasse desto aufwändiger sind die regulatorischen Anforderungen für die Zulassung bzw. Zertifizierung.
Das europäische Zertifizierungssystem ist dezentral organisiert: Prüfstellen (sog. Benannte Stellen), die eine wichtige Rolle im Zertifizierungsprozess spielen, sind privatwirtschaftliche Unternehmen. Ein Hersteller kann aus rund 80 Prüfstellen in ganz Europa auswählen, um für sein Produkt die Zertifizierung in Form des CE-Zeichens zu beantragen. Da diese Prüfstellen ein hohes wirtschaftliches Interesse daran haben, Kunden langfristig zu binden, wird kritisiert, dass die Prüfungen möglicherweise zu nachsichtig seien. Klinische Studien inklusive Tests der Produkte am Menschen sind häufig nicht vorgesehen. Der Fokus liegt sehr stark auf der Dokumentation. Das Produkt selbst muss nicht immer in Augenschein genommen werden.
Medienwirksame große Schadenfälle im Zusammenhang mit minderwertigen Brustimplantaten und fehlerhaften Hüftimplantaten führten 2016 zur Verabschiedung einer neuen europäischen Medizinprodukte-Verordnung, die das bestehende Zertifizierungssystem grundsätzlich nicht in Frage stellt, aber durch zusätzliche Anforderungen die Sicherheit von Implantaten erhöhen soll.
In den USA ist das Zulassungsverfahren für Medizinprodukte staatlich und zentral durch die Food and Drug Administration (FDA) geregelt. Hier wird grundsätzlich zwischen zwei Verfahren unterschieden: dem „Premarket Approval“, kurz PMA, und der „Premarket Notifikation“, auch 510(k)-Verfahren genannt. Für Produkte der höchsten Risikoklasse III, zu der auch Knie- und Hüftimplantate gehören, ist eine PMA-Zulassung erforderlich. Ähnlich der Zulassung von Arzneimitteln ist der Nachweis der Sicherheit und Wirksamkeit durch klinische Prüfungen Voraussetzung für die Zulassung. Eine solche PMA-Zulassung stellt nach höchstrichterlicher Entscheidung eine Art „Qualitätssiegel“ dar und reduziert das Risiko für die Hersteller, Ziel von Produkthaftpflichtklagen zu werden.
Schlupfloch statt klinischer Studien
Das deutlich weniger aufwendige 510(k)-Verfahren dagegen – vorgesehen für die weniger risikobehafteten Medizinprodukte – erfordert in der Regel nur den Nachweis, dass ein neues Produkt weitgehend einem Vorgängerprodukt entspricht. Klinische Prüfungen sind nicht erforderlich. Durch gesetzliche Übergangsregelungen wird dieses vereinfachte Verfahren jedoch auch bei einigen Produkten der höchsten Risikoklasse III angewendet. Dies führte dazu, dass sich Hersteller letztlich auf ein „Urprodukt“ aus der Zeit vor 1976 beziehen, für das nie der Nachweis der Sicherheit und Wirksamkeit erbracht werden musste. Besonders für Produkte der Risikoklasse III entstand so eine Art Schlupfloch, um aufwendige klinische Studien zu umgehen und besonders risikobehaftete Produkte ohne ausreichenden Sicherheitsnachweis auf den Markt bringen zu können. Hersteller von „510(k)-Implantaten“ tragen ein deutlich höheres Risiko, Ziel von Produkthaftpflichtklagen zu werden, da diesen das PMA-Qualitätssiegel der FDA fehlt.
Qualitäts- und Risikomanagement
Zentrale Faktoren zur Reduzierung des Produkthaftpflichtrisikos bei Implantaten sind ein professionelles Qualitäts- und Risikomanagement durch den Hersteller. Beides kann gesetzlich vorgeschrieben werden. Ein Qualitätsmanagement muss nicht nur sicherheitsrelevante Anforderungen an Produkte berücksichtigen. Die Prüfung der Produktsicherheit ist nämlich mehr als die Prüfung der Produktqualität. Sie beurteilt auch die Fehleranfälligkeit, die Auswirkungen und die inhärente Sicherheit eines Produkts. Solche Risikomanagement-Aspekte haben also eine hohe Relevanz in der Produkthaftpflichtversicherung und sollten beim Underwriting unbedingt berücksichtigt werden. Eine fehlerhafte Einschätzung der Produktrisiken kann für den Versicherer teuer werden und für den Hersteller sogar die Insolvenz bedeuten. Eine Leitlinie zum Risikomanagement bietet die Internationale Norm ISO 14971 für Medizinprodukte. Neben einer Beschreibung zu den grundsätzlichen Anforderungen beinhaltet sie alle relevanten Aspekte des Risikomanagements, wie Risikoanalyse, Risikobewertung, Risikosteuerung, Akzeptanz des Restrisikos und das Reporting. Eine entsprechende Dokumentation sollte dem Underwriter zur eingehenden Prüfung vorliegen. Im Zweifelsfall sollte er sich nicht nur auf diese Dokumentation verlassen, sondern auch eine Risikoanalyse vor Ort in Erwägung ziehen.
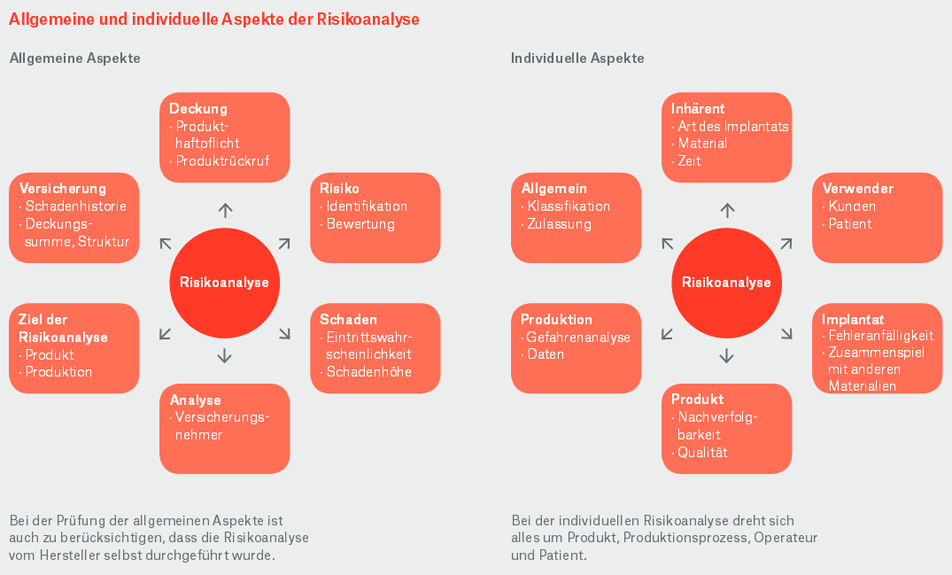
Bei der Risikoanalyse kann man unterscheiden zwischen den allgemeinen Aspekten, die eher die Rahmenbedingungen erfassen, und der individuellen Analyse, die wesentlich stärker auf das Produkt selbst, seine Herstellung und seine Verwendung abzielt:
Ein Produkt mit Großschadenpotenzial
Implantate nehmen in der Produkthaftpflicht eine besondere Stellung ein. Sie bergen Großschadenpotenzial und müssen deshalb besonders hohe Qualitätsanforderungen erfüllen. Neben multinationalen großen Herstellern sind auch sehr viele kleinere und mittlere Unternehmen in diesem Geschäftsfeld tätig und sehen sich mit vielfältigen Risiken konfrontiert: Permanente Produktoptimierungen, der Einsatz neuer Materialien und das Ziel möglichst patientenindividueller Lösungen bergen ein erhebliches Entwicklungsrisiko. Im Schadenfall ist eine Abgrenzung zwischen Produkthaftpflicht und Berufshaftpflicht des Operateurs mitunter schwierig: Ist wirklich das Produkt fehlerhaft oder hat womöglich der Operateur nachlässig gearbeitet? Wurde der Operateur nicht ausreichend vom Hersteller des Implantats instruiert?
Letztlich bedeutet der „Ausbau“ eines Implantats infolge eines Produktrückrufs für die Patienten zusätzliche belastende Krankenhausaufenthalte und ist in der Regel mit deutlich höheren Kosten verbunden als der Rückruf und Ausbau von technischen Teilen zum Beispiel in der Automobilindustrie. Hohe Schadenersatzforderungen können zur schwer kalkulierbaren Belastung für Hersteller werden.
Risikobeobachtung bei Munich Re
Unsere Experten beobachten die Risikoentwicklung bei Implantaten sehr aufmerksam und teilen ihren Erfahrungsschatz gerne mit ihren Kunden bzw. stehen ihnen als Berater in Bezug auf ein Risikoadäquates Underwriting, das hier unerlässlich Ist, jederzeit zur Verfügung.